Knochenmark ist das spongiöse Gewebe in einigen der Knochen im Körper, einschließlich der Hüfte und Oberschenkelknochen. Knochenmark enthält unreife Zellen, so genannte Stammzellen.
Viele Menschen mit Blutkrebs, wie Leukämie und Lymphom, Sichelzellenanämie und anderen lebensbedrohlichen Krankheiten, verlassen sich auf Knochenmark- oder Nabelschnurbluttransplantate, um zu überleben.
Gesundes Knochenmark und Blutzellen werden benötigt, um zu leben. Wenn eine Erkrankung das Knochenmark beeinflusst, so dass es nicht mehr wirksam funktionieren kann, könnte eine Knochenmarks- oder Nabelschnurbluttransplantation die beste Behandlungsoption sein; Für einige Patienten ist es die einzige mögliche Heilung.
Schnelle Fakten über Knochenmark
Hier sind einige wichtige Punkte über Knochenmark. Mehr Details finden Sie im Hauptartikel.
- Knochenmark produziert täglich 200 Milliarden neue rote Blutkörperchen, weiße Blutkörperchen und Blutplättchen.
- Knochenmark enthält mesenchymale und hämatopoetische Stammzellen.
- Etwa 10.000 Menschen in den USA werden jedes Jahr mit Krankheiten diagnostiziert, die eine Knochenmarktransplantation erfordern.
- Mehrere Krankheiten stellen eine Gefahr für das Knochenmark dar und verhindern, dass das Knochenmark Stammzellen in essentielle Zellen verwandelt.
Was ist Knochenmark?
Knochenmark ist weiches gelatinöses Gewebe, das die Markhöhlen, die Knochenzentren, füllt. Die beiden Arten von Knochenmark sind rotes Knochenmark, bekannt als myeloisches Gewebe, und gelbem Knochenmark oder Fettgewebe
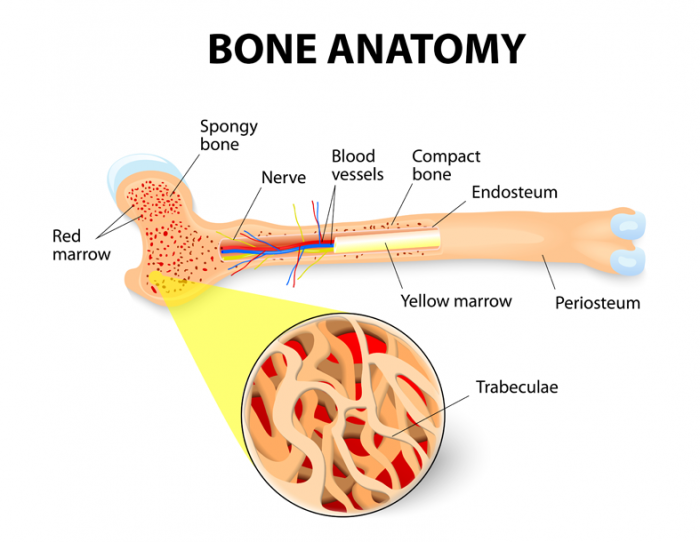
Beide Arten von Knochenmark sind mit Blutgefäßen und Kapillaren angereichert.2
Knochenmark produziert täglich mehr als 200 Milliarden neue Blutzellen.8 Die meisten Blutzellen im Körper entwickeln sich aus Zellen im Knochenmark.5
Knochenmarkstammzellen
Das Knochenmark enthält zwei Arten von Stammzellen, mesenchymale und hämatopoetische.
Rotes Knochenmark besteht aus einem zarten, stark vaskulären fibrösen Gewebe, das hämatopoetische Stammzellen enthält. Dies sind blutbildende Stammzellen.
Gelbes Knochenmark enthält mesenchymale Stammzellen, auch bekannt als Knochenmarkstromazellen. Diese produzieren Fett, Knorpel und Knochen
Stammzellen sind unreife Zellen, die sich in eine Reihe verschiedener Zelltypen verwandeln können.
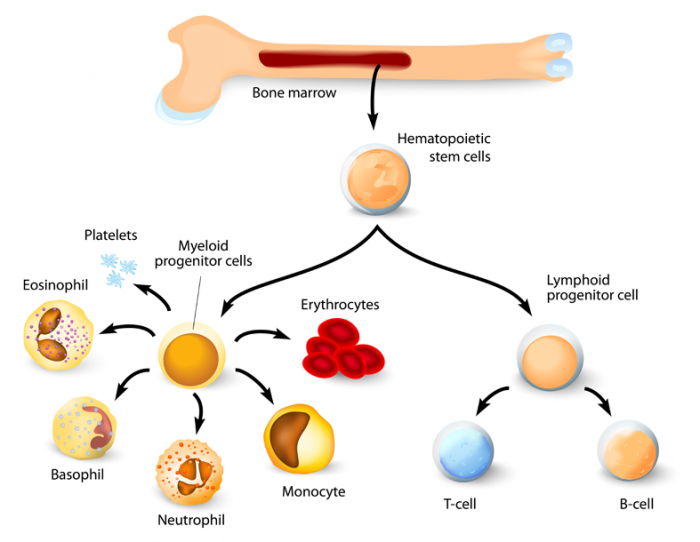
Hämatopoetische Stammzellen im Knochenmark lassen zwei Haupttypen von Zellen entstehen: myeloide und lymphoide Linien. Diese umfassen Monozyten, Makrophagen, Neutrophile, Basophile, Eosinophile, Erythrozyten, dendritische Zellen und Megakaryozyten oder Blutplättchen sowie T-Zellen, B-Zellen und natürliche Killerzellen.
Die verschiedenen Arten von hämatopoetischen Stammzellen unterscheiden sich in ihrer Regenerationsfähigkeit und Potenz.
Einige sind multipotent, oligopotent oder unipotent, abhängig davon, wie viele Arten von Zellen sie erzeugen können.
Pluripotente hämatopoetische Stammzellen haben folgende Eigenschaften:
- Erneuerung: Sie können eine andere Zelle reproduzieren, die mit sich selbst identisch ist.
- Differenzierung: Sie können eine oder mehrere Untergruppen von reiferen Zellen erzeugen.
Der Prozess der Entwicklung von verschiedenen Blutzellen aus diesen pluripotenten Stammzellen wird als Hämatopoese bezeichnet
Es sind diese Stammzellen, die bei der Knochenmarktransplantation benötigt werden.
Stammzellen teilen sich ständig und produzieren neue Zellen. Einige neue Zellen bleiben als Stammzellen erhalten und andere durchlaufen eine Reihe von Reifungsstadien, als Vorstufen- oder Blastenzellen, bevor sie zu reifen Blutzellen werden. Stammzellen vermehren sich schnell, um jeden Tag Millionen von Blutzellen zu bilden.10
Blutzellen haben eine begrenzte Lebensdauer. Dies ist etwa 100-120 Tage für rote Blutkörperchen. Sie werden ständig ersetzt. Die Produktion gesunder Stammzellen ist lebenswichtig
Die Blutgefäße wirken als Barriere, um zu verhindern, dass unreife Blutzellen das Knochenmark verlassen.
Nur reife Blutzellen enthalten die Membranproteine, die erforderlich sind, um sich an das Blutgefäßendothel anzuheften und dieses zu passieren. Hämatopoetische Stammzellen können jedoch die Knochenmarkbarriere überwinden. Diese können aus peripherem oder zirkulierendem Blut gewonnen werden.15
Die blutbildenden Stammzellen im roten Knochenmark können sich vermehren und zu drei signifikanten Blutzellen heranreifen, die jeweils einen eigenen Job haben:
- Rote Blutkörperchen (Erythrozyten) transportieren Sauerstoff um den Körper herum
- Weiße Blutkörperchen (Leukozyten) helfen Infektionen und Krankheiten zu bekämpfen. Weiße Blutzellen umfassen Lymphozyten – die Eckpfeiler des Immunsystems – und myeloide Zellen, zu denen Granulozyten gehören: Neutrophile, Monozyten, Eosinophile und Basophile
- Blutplättchen (Thrombozyten) helfen bei der Gerinnung nach Verletzungen. Thrombozyten sind Fragmente des Zytoplasmas von Megakaryozyten, einer weiteren Knochenmarkszelle.
Sobald sie reif sind, bewegen sich diese Blutzellen aus dem Knochenmark in den Blutkreislauf, wo sie wichtige Funktionen erfüllen, die erforderlich sind, um den Körper am Leben und gesund zu erhalten
Mesenchymale Stammzellen befinden sich in der Knochenmarkhöhle. Sie differenzieren sich in eine Reihe von Stroma-Linien wie:
- Chondrozyten (Knorpelbildung)
- Osteoblasten (Knochenbildung)
- Osteoklasten
- Adipozyten (Fettgewebe)
- Myozyten (Muskel)
- Makrophagen
- Endothelzellen
- Fibroblasten.6
rotes Knochenmark
Rotes Knochenmark produziert alle roten Blutkörperchen und Blutplättchen bei menschlichen Erwachsenen und etwa 60 bis 70 Prozent der Lymphozyten. Andere Lymphozyten beginnen ihr Leben im roten Knochenmark und werden vollständig im lymphatischen Gewebe einschließlich Thymus, Milz und Lymphknoten gebildet
Zusammen mit der Leber und der Milz spielt rotes Knochenmark auch eine Rolle bei der Beseitigung alter roter Blutkörperchen.
Gelbes Knochenmark
Gelbes Knochenmark dient hauptsächlich als Fettspeicher. Es hilft, Nahrung zu liefern und die richtige Umgebung für den Knochen zu erhalten, um zu funktionieren. Unter bestimmten Bedingungen, wie starkem Blutverlust oder Fieber, kann das Gelbmark jedoch zu rotem Knochenmark zurückkehren.1
Gelbes Knochenmark ist gewöhnlich in den zentralen Hohlräumen der langen Knochen lokalisiert und wird im allgemeinen von einer Schicht aus rotem Knochenmark mit langen Knochenbälkchen (balkenartige Strukturen) innerhalb eines schwammartigen netzartigen Gerüstes umgeben
Knochenmark Timeline
Vor der Geburt entwickelt sich das Knochenmark gegen Ende der fetalen Entwicklung in der Klavikula. Es wird ungefähr 3 Wochen später aktiv. Das Knochenmark übernimmt in der 32. bis 36. Schwangerschaftswoche als wichtigstes hämatopoetisches Organ die Leber.
Das Knochenmark bleibt bis zum Alter von etwa 7 Jahren rot, da die Notwendigkeit für eine kontinuierliche Blutbildung hoch ist. Wenn der Körper altert, wird das rote Knochenmark allmählich durch gelbes Fettgewebe ersetzt. Erwachsene haben durchschnittlich etwa 2,6 kg Knochenmark, von denen etwa die Hälfte rot ist.3
Bei Erwachsenen ist die höchste Konzentration von rotem Knochenmark in den Knochen der Wirbel, Hüfte (Ilium), Brustbein (Sternum), Rippen, Schädel und an den metaphysären und epiphysären Enden der langen Knochen des Arms (Humerus) und Bein ( Femur und Tibia). Alle anderen schwammigen oder schwammartigen Knochen und zentralen Hohlräume der langen Knochen sind mit gelbem Knochenmark gefüllt.
Funktion
Die meisten roten Blutkörperchen, Blutplättchen und die meisten weißen Blutkörperchen bilden sich im roten Knochenmark. Gelbes Knochenmark produziert Fett, Knorpel und Knochen.
Weiße Blutzellen überleben von einigen Stunden bis zu einigen Tagen, Thrombozyten für ungefähr 10 Tage und rote Blutzellen für ungefähr 120 Tage. Diese Zellen müssen ständig durch das Knochenmark ersetzt werden, da jede Blutzelle eine bestimmte Lebenserwartung hat.
Bestimmte Bedingungen können eine zusätzliche Produktion von Blutzellen auslösen. Dies kann passieren, wenn der Sauerstoffgehalt in Körpergeweben niedrig ist, wenn Blut oder Anämie verloren geht oder wenn die Anzahl der roten Blutkörperchen abnimmt. Wenn dies geschieht, produzieren und geben die Nieren Erythropoietin frei, ein Hormon, das das Knochenmark stimuliert, um mehr rote Blutkörperchen zu produzieren.
Das Knochenmark produziert und gibt auch mehr weiße Blutkörperchen als Reaktion auf Infektionen und mehr Blutplättchen als Reaktion auf Blutungen. Wenn eine Person einen ernsthaften Blutverlust erleidet, kann gelbes Knochenmark aktiviert und in rotes Knochenmark umgewandelt werden.
Gesundes Knochenmark ist wichtig für eine Reihe von Systemen und Aktivitäten.
Kreislauf
Das Kreislaufsystem berührt jedes Organ und System im Körper. Es beinhaltet eine Reihe von verschiedenen Zellen mit einer Vielzahl von Funktionen. Rote Blutkörperchen transportieren Sauerstoff zu Zellen und Geweben, Blutplättchen werden im Blut transportiert, um Blutgerinnsel nach einer Verletzung zu unterstützen, und weiße Blutkörperchen werden zu Infektionsherden oder Verletzungen transportiert.
Hämoglobin
Hämoglobin ist das Protein in roten Blutkörperchen, das ihnen ihre Farbe gibt. Hämoglobin sammelt Sauerstoff in den Lungen, transportiert es in die roten Blutkörperchen und gibt Sauerstoff an Gewebe wie Herz, Muskeln und Gehirn ab. Kohlendioxid (CO2), ein Abfallprodukt der Atmung, wird ebenfalls durch Hämoglobin entfernt und zur Ausatmung zurück in die Lunge geschickt.
Eisen
Eisen ist ein wichtiger Nährstoff für die menschliche Physiologie. Es verbindet sich mit Protein, um das Hämoglobin in roten Blutkörperchen zu bilden und ist essentiell für die Produktion roter Blutkörperchen (Erythropoese). Der Körper speichert Eisen in Leber, Milz und Knochenmark. Das meiste Eisen, das täglich für die Herstellung von Hämoglobin benötigt wird, stammt aus dem Recycling alter roter Blutkörperchen.
rote Blutkörperchen
Die Produktion von roten Blutkörperchen wird Erythropoese genannt. Es dauert ungefähr 7 Tage, bis sich eine engagierte Stammzelle zu einem voll funktionsfähigen roten Blutkörperchen entwickelt hat. Wenn rote Blutkörperchen altern, werden sie weniger aktiv und anfälliger.
Alternde rote Zellen werden durch eine Art von weißen Blutkörperchen oder Makrophagen in einem Prozess, der als Phagozytose bekannt ist, entfernt oder aufgefressen. Der Inhalt dieser Zellen wird ins Blut abgegeben. Das dabei freigesetzte Eisen wird entweder zur Produktion neuer roter Blutkörperchen in das Knochenmark oder zur Lagerung in die Leber oder in andere Gewebe transportiert.
Normalerweise werden etwa 1 Prozent der gesamten roten Blutkörperchen des Körpers jeden Tag ersetzt. Bei einem gesunden Menschen werden jeden Tag rund 200 Milliarden rote Blutkörperchen produziert.
weiße Blutkörperchen
Das Knochenmark produziert viele Arten von weißen Blutkörperchen. Diese sind notwendig für ein gesundes Immunsystem. Sie verhindern und bekämpfen Infektionen.
Die wichtigsten Arten von weißen Blutkörperchen oder Leukozyten sind:
1) Lymphozyten
Lymphozyten werden im Knochenmark produziert. Sie bilden natürliche Antikörper zur Bekämpfung von Infektionen durch Viren, die durch Nase, Mund oder andere Schleimhäute in den Körper gelangen, oder durch Schnitte und Schürfwunden. Spezifische Zellen erkennen die Anwesenheit von fremden Eindringlingen (Antigenen), die in den Körper eindringen und ein Signal an andere Zellen senden, um die Antigene anzugreifen.
Die Anzahl der Lymphozyten erhöht sich als Reaktion auf diese Invasionen. Es gibt zwei Haupttypen von Lymphozyten: B- und T-Lymphozyten.
2) Monozyten
Monozyten werden im Knochenmark produziert. Reife Monozyten haben eine Lebenserwartung im Blut von nur 3 bis 8 Stunden, aber wenn sie sich in das Gewebe bewegen, reifen sie zu größeren Zellen heran, die Makrophagen genannt werden. Makrophagen können in den Geweben lange Zeit überleben, wo sie Bakterien, einige Pilze, tote Zellen und anderes körperfremdes Material verschlingen und zerstören.
3) Granulozyten
Granulozyt ist die Familie oder Kollektivname für drei Arten von weißen Blutkörperchen: Neutrophile, Eosinophile und Basophile. Die Entwicklung eines Granulozyten kann zwei Wochen dauern, aber diese Zeit wird verkürzt, wenn eine erhöhte Bedrohung, wie eine bakterielle Infektion, vorliegt.
Knochenmark speichert eine große Reserve von reifen Granulozyten. Für jeden Granulozyten, der im Blut zirkuliert, können 50 bis 100 Zellen im Mark warten, um in den Blutstrom freigesetzt zu werden.Als Ergebnis kann die Hälfte der Granulozyten im Blutstrom verfügbar sein, um eine Infektion im Körper innerhalb von 7 Stunden nach Feststellung einer Infektion aktiv zu bekämpfen.
Sobald ein Granulozyt das Blut verlassen hat, kehrt er normalerweise nicht mehr zurück. Ein Granulozyt kann abhängig von den Bedingungen bis zu 4 bis 5 Tage in den Geweben überleben, überlebt jedoch nur einige Stunden im Kreislauf.
4) Neutrophile
Neutrophile sind die häufigsten Granulozyten. Sie können Bakterien und Viren angreifen und zerstören.
5) Eosinophile
Eosinophile sind in den Kampf gegen viele Arten von parasitären Infektionen und gegen die Larven von parasitären Würmern und anderen Organismen beteiligt. Sie sind auch an einigen allergischen Reaktionen beteiligt.
6) Basophile
Basophile sind die am wenigsten verbreiteten weißen Blutkörperchen und reagieren auf verschiedene Allergene, die die Freisetzung von Histaminen, Heparin und anderen Substanzen verursachen.
Heparin ist ein Antikoagulans. Es verhindert, dass Blut gerinnt. Histamine sind Vasodilatatoren, die Reizungen und Entzündungen verursachen. Das Freisetzen dieser Substanzen macht einen Erreger durchlässiger und ermöglicht es weißen Blutkörperchen und Proteinen, in das Gewebe einzudringen, um mit dem Pathogen in Kontakt zu kommen.
Die Reizung und Entzündung in Geweben betroffen von einem Allergen ist Teil der Reaktion bei Heuschnupfen, einige Formen von Asthma, Nesselsucht und in seiner schwersten Form, anaphylaktischer Schock gesehen.
Thrombozyten
Knochenmark produziert Thrombozyten in einem Prozess, der als Thrombopoese bekannt ist. Blutplättchen werden benötigt, um Blut zu koagulieren und Blutgerinnsel zu bilden, Blutungen zu stoppen.
Plötzlicher Blutverlust löst an der Stelle einer Verletzung oder Wunde eine Thrombozytenaktivität aus. Hier verklumpen die Plättchen und verbinden sich mit anderen Substanzen zu Fibrin. Fibrin hat eine fadenartige Struktur und bildet einen äußeren Schorf oder ein Gerinnsel.
Plättchenmangel führt dazu, dass der Körper leichter blutet und blutet. Blut kann an einer offenen Wunde nicht gut gerinnen, und es kann ein größeres Risiko für innere Blutungen bestehen, wenn die Thrombozytenzahl sehr niedrig ist.
Lymphsystem
Das lymphatische System besteht aus lymphatischen Organen wie Knochenmark, Mandeln, Thymus, Milz und Lymphknoten.
Alle Lymphozyten entwickeln sich im Knochenmark aus unreifen Zellen, so genannten Stammzellen. Lymphozyten, die in der Thymusdrüse (hinter dem Brustbein) reifen, nennt man T-Zellen. Diejenigen, die im Knochenmark oder den lymphatischen Organen reifen, werden B-Zellen genannt
Immunsystem
Das Immunsystem schützt den Körper vor Krankheiten. Es tötet unerwünschte Mikroorganismen wie Bakterien und Viren, die in den Körper eindringen können.
Wie bekämpft das Immunsystem Infektionen?
Kleine Drüsen, die Lymphknoten genannt werden, sind im ganzen Körper verstreut. Sobald Lymphozyten im Knochenmark gebildet sind, wandern sie zu den Lymphknoten. Die Lymphozyten können dann zwischen jedem Knoten durch Lymphkanäle wandern, die sich an großen Drainagekanälen treffen, die sich in ein Blutgefäß entleeren. Lymphozyten gelangen durch diese Gänge in das Blut.
Drei wichtige Arten von Lymphozyten spielen eine wichtige Rolle im Immunsystem:
B-Lymphozyten (B-Zellen)
Diese Zellen stammen aus hämatopoetischen Stammzellen im Knochenmark von Säugetieren.
B-Zellen exprimieren B-Zell-Rezeptoren (BCRs) auf der Oberfläche der Zellen. Diese ermöglichen es der Zelle, sich an ein Antigen auf der Oberfläche einer eindringenden Mikrobe oder eines anderen antigenen Agens zu binden.
Aus diesem Grund sind B-Zellen als Antigen-präsentierende Zellen bekannt, da sie andere Zellen des Immunsystems auf eine eindringende Mikrobe hinweisen.
B-Zellen sezernieren auch Antikörper, die an der Oberfläche von Infektion verursachenden Mikroben anhaften. Diese Antikörper sind Y-förmig und jeder ist einem spezialisierten "Schloss" ähnlich, in das ein passender Antigen- "Schlüssel" passt. Als solche reagiert jeder Y-förmige Antikörper auf eine andere Mikrobe, wodurch eine größere Immunantwort mit dem Ziel der Infektionsbekämpfung ausgelöst wird.
Unter bestimmten Umständen identifizieren B-Zellen fälschlicherweise die normalen Zellen des menschlichen Körpers als Antigene, die eine Reaktion des Immunsystems erfordern. Dies ist der Mechanismus, der hinter der Entwicklung von Autoimmunerkrankungen wie Multipler Sklerose, Sklerodermie und Typ-1-Diabetes steht.
T-Lymphozyten (T-Zellen)
Diese Zellen sind so genannt, weil sie im Thymus reifen, einem kleinen Organ in der oberen Brust, genau hinter dem Sternum (einige T-Zellen reifen in den Mandeln). Es gibt viele verschiedene Arten von T-Zellen, und sie erfüllen eine Reihe von Funktionen als Teil der adaptiven zellvermittelten Immunität. T-Zellen helfen B-Zellen, Antikörper gegen eindringende Bakterien, Viren oder andere Mikroben zu bilden.
Im Gegensatz zu B-Zellen verschlingen und zerstören einige T-Zellen Pathogene direkt nach Bindung an das Antigen auf der Oberfläche der Mikrobe.
Natürliche Killer-T-Zellen, nicht zu verwechseln mit natürlichen Killerzellen des angeborenen Immunsystems, überbrücken das adaptive und das angeborene Immunsystem. NKT-Zellen erkennen Antigene, die anders als viele andere Antigene präsentiert werden, und können die Funktionen von T-Helferzellen und zytotoxischen T-Zellen ausführen. Sie können auch einige Tumorzellen erkennen und eliminieren.
Natürliche Killerzellen (NK)
Diese sind eine Art von Lymphozyten, die Zellen, die mit einem Virus infiziert wurden, direkt angreifen.
Transplantationen
Eine Knochenmarktransplantation kann aus verschiedenen Gründen verwendet werden.
- Es kann erkranktes, funktionsloses Knochenmark durch gesundes funktionierendes Knochenmark ersetzen. Dies wird für Erkrankungen wie Leukämie, aplastische Anämie und Sichelzellenanämie verwendet.
- Es kann ein neues Immunsystem regenerieren, das bestehende oder bleibende Leukämien oder andere Krebsarten bekämpfen kann, die nicht durch Chemotherapie oder Bestrahlung getötet wurden.
- Es kann Knochenmark ersetzen und seine normale Funktion wiederherstellen, nachdem hohe Dosen von Chemotherapie oder Bestrahlung verabreicht wurden, um eine Malignität zu behandeln.
- Es kann das Knochenmark durch genetisch gesundes, funktionierendes Knochenmark ersetzen, um weitere Schäden durch genetische Krankheitsprozesse wie Hurler-Syndrom und Adrenoleukodystrophie zu verhindern.
Stammzellen befinden sich hauptsächlich an vier Orten:
- ein Embryo
- Knochenmark
- peripheres Blut, in Blutgefäßen im ganzen Körper gefunden
- Nabelschnurblut, in der Nabelschnur gefunden und nach der Geburt gesammelt9
Stammzellen für die Transplantation werden von jedem von diesen erhalten, mit Ausnahme des Fötus.
Die hämatopoetische Stammzelltransplantation umfasst die intravenöse Infusion von Stammzellen, die aus Knochenmark, peripherem Blut oder Nabelschnurblut gewonnen wurden.
Dies wird verwendet, um die hämatopoetische Funktion bei Patienten wieder herzustellen, deren Knochenmark oder Immunsystem beschädigt oder defekt ist.17
Laut dem ersten Bericht des weltweiten Netzwerks für Blut- und Knochenmarktransplantation werden jedes Jahr weltweit mehr als 50.000 erste Transplantationsverfahren für hämatopoetische Stammzellen, 28.000 autologe Transplantationsverfahren und 21.000 allogene Transplantationsverfahren durchgeführt.
Diese Zahl erhöht sich jährlich um 10 bis 20 Prozent. Verringerungen von Organschäden, Infektionen und schweren, akuten Graft-versus-Host-Erkrankungen (GVHD) scheinen zu verbesserten Ergebnissen beizutragen.
In einer Studie an 854 Patienten, die mindestens 2 Jahre nach der autologen hämatopoetischen Stammzelltransplantation (HSZT) für hämatologische Malignität überlebt hatten, lebten 68,8 Prozent noch 10 Jahre nach der Transplantation.17
Die Knochenmarktransplantation ist die führende Behandlung bei Erkrankungen, die die Funktionsfähigkeit des Knochenmarks bedrohen, wie Leukämie.
Eine Transplantation kann dazu beitragen, die Fähigkeit des Körpers, Blutzellen zu produzieren, wiederherzustellen und seine Anzahl auf ein normales Niveau zu bringen. Krankheiten, die mit einer Knochenmarktransplantation behandelt werden können, umfassen sowohl Krebs als auch nicht-krebsartige Krankheiten.
Krebserkrankungen können oder können nicht spezifisch Blutzellen einschließen, aber Krebsbehandlung kann die Fähigkeit des Körpers zerstören, neue Blutzellen herzustellen.
Eine Person mit Krebs wird normalerweise vor der Transplantation eine Chemotherapie erhalten. Dies wird das kompromittierte Knochenmark beseitigen.
Ein passender Spender, in den meisten Fällen ein nahes Familienmitglied, wird dann sein Knochenmark geerntet und zur Transplantation vorbereitet
Arten der Knochenmarktransplantation
Zu den Arten der Knochenmarktransplantation gehören:
- Autologe Transplantation: Patienten erhalten ihre eigenen Stammzellen aus ihrem peripheren oder Nabelschnurblut, um das Knochenmark aufzufüllen
- Syngenei Transplantat: Patienten erhalten Stammzellen von ihrem eineiigen Zwilling
- Allogene Transplantation: Patienten erhalten übereinstimmende Stammzellen von ihren Geschwistern, Eltern oder einem nicht verwandten Spender
- Haploidentische Transplantation: eine Behandlungsoption für die ca. 70% der Patienten, die keinen HLA-identischen passenden Spender haben
- Nabelschnurblut: eine Art allogene Transplantation. Stammzellen werden direkt nach der Geburt aus der Nabelschnur eines Neugeborenen entnommen. Die Stammzellen werden eingefroren und gelagert, bis sie für eine Transplantation benötigt werden. Nabelschnurblutzellen sind sehr unreif, so dass es weniger Bedarf nach Anpassung gibt, aber das Blutbild dauert viel länger, um sich zu erholen.
Gewebetyp
Der Gewebetyp einer Person ist definiert als die Art von menschlichem Leukozytenantigen (HLA) auf der Oberfläche der meisten Zellen ihres Körpers. HLA ist ein Protein oder Marker, mit dem der Körper feststellen kann, ob die Zelle zum Körper gehört oder nicht.
Um zu überprüfen, ob der Gewebetyp kompatibel ist, beurteilen Ärzte, wie viele Proteine auf der Oberfläche der Blutzellen von Spender und Empfänger übereinstimmen. Es gibt Millionen verschiedener Gewebetypen, aber einige sind häufiger als andere.
Der Tissuetyp wird geerbt, und die Typen werden von jedem Elternteil weitergegeben. Dies bedeutet, dass ein Verwandter eher einen passenden Gewebetyp hat.
Wenn jedoch ein geeigneter Knochenmarkspender nicht von Familienmitgliedern gefunden werden kann, werden Ärzte versuchen, jemanden mit einem kompatiblen Gewebetyp auf dem Knochenmarkspenderregister zu finden.
Tests vor der Transplantation
Vor der Knochenmarktransplantation werden mehrere Tests durchgeführt, um mögliche Probleme zu identifizieren.
Tests beinhalten:
- Gewebetypisierung und eine Vielzahl von Bluttests
- Brust Röntgen
- Lungenfunktionstests
- CT- oder CAT-Scans
- Herzfunktionstests einschließlich Elektrokardiogramm und Echokardiogramm (EKG)
- Knochenmarkbiopsie
- Skelettsurvey
Darüber hinaus ist eine vollständige zahnärztliche Untersuchung vor einer Knochenmarktransplantation erforderlich, um das Infektionsrisiko zu reduzieren. Andere Vorsichtsmaßnahmen werden auch vor der Transplantation getroffen, um das Infektionsrisiko des Patienten zu reduzieren.
Knochenmark ernten
Knochenmark kann zur Untersuchung durch Knochenmarkbiopsie und Knochenmarkaspiration erhalten werden.
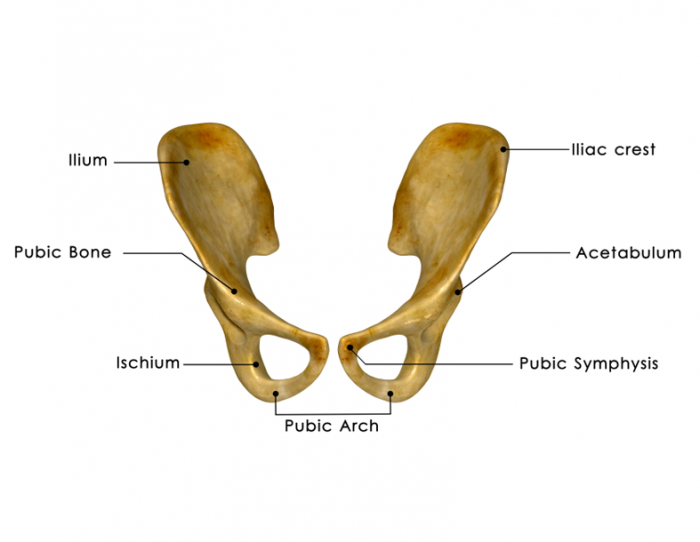
Die Knochenmarkentnahme ist zu einem relativ routinemäßigen Verfahren geworden. Es wird im Allgemeinen von den hinteren Beckenkämmen angesaugt, während der Spender unter Regional- oder Vollnarkose steht.17
Es kann auch vom Sternum und von der oberen Tibia bei Kindern entnommen werden, da es immer noch eine beträchtliche Menge an rotem Knochenmark enthält.
Der Arzt wird eine Nadel in den Knochen einführen, normalerweise in die Hüfte, und etwas Knochenmark abziehen. Es wird dann gespeichert und eingefroren.
Richtlinien, die vom National Marrow Donor Program (NMDP) festgelegt wurden, begrenzen das entnommene Knochenmarkvolumen auf 15 ml / kg Spendergewicht. Eine Dosis von 1 · 10³ und 2 · 10 mark mononukleären Markzellen pro Kilogramm ist erforderlich, um das Einwachsen in autologe und allogene Knochenmarktransplantate zu etablieren.
Komplikationen im Zusammenhang mit der Knochenmarkentnahme sind selten. Sie beinhalten Probleme im Zusammenhang mit Anästhesie, Infektionen und Blutungen.
Eine andere Möglichkeit, die Knochenmarkfunktion zu bewerten, besteht darin, bestimmte Arzneimittel zu verabreichen, die die Freisetzung von Stammzellen aus dem Knochenmark in zirkulierendes Blut stimulieren.Die Blutprobe wird dann erhalten und Stammzellen werden für die mikroskopische Untersuchung isoliert. Bei Neugeborenen können Stammzellen aus der Nabelschnur entnommen werden.
Wie wird Knochenmark transplantiert?
Vor der Transplantation kann Chemotherapie, Bestrahlung oder beides gegeben werden. Dies kann auf zwei Arten geschehen:
- Ablative (myeloablative) Behandlung: Hochdosis-Chemotherapie, Bestrahlung oder beides wird verabreicht, um Krebszellen abzutöten. Dies tötet auch alles gesunde Knochenmark, das übrig bleibt, und lässt neue Stammzellen im Knochenmark wachsen
- Behandlung mit reduzierter Intensität oder Mini-Transplantation: Patienten erhalten vor einer Transplantation niedrigere Dosen an Chemotherapie und Bestrahlung. Dies ermöglicht älteren Patienten und solchen mit anderen gesundheitlichen Problemen eine Transplantation.
Eine Stammzelltransplantation wird normalerweise nach Abschluss der Chemotherapie und Bestrahlung durchgeführt.
Die Infusion von Knochenmark oder peripherem Blut ist ein relativ einfacher Prozess, der am Krankenbett durchgeführt wird. Das Knochenmarkprodukt wird über einen Zeitraum von mehreren Stunden durch eine zentrale Vene durch ein IV-Rohr infundiert. Autologe Produkte sind fast immer kryokonserviert; Sie werden am Bett aufgetaut und über einen Zeitraum von mehreren Minuten rasch infundiert.17
Nach Eintritt in den Blutkreislauf wandern die hämatopoetischen Stammzellen zum Knochenmark. Dort beginnen sie, neue weiße Blutkörperchen, rote Blutkörperchen und Blutplättchen in einem Prozess zu produzieren, der als Engraftment bekannt ist. Engraftment tritt normalerweise 2 bis 4 Wochen nach der Transplantation auf.4
In den meisten Fällen wurde eine minimale Toxizität beobachtet. ABO-nicht übereinstimmende Knochenmarksinfusionen können manchmal zu hämolytischen Reaktionen führen. Dimethylsulfoxid (DMSO), das für die Kryokonservierung von Stammzellen verwendet wird, kann zu einer Gesichtsrötung, einem Kitzeln im Hals und einem starken Geschmack im Mund (dem Geschmack von Knoblauch) führen. In seltenen Fällen kann DMSO Bradykardie, Bauchschmerzen, Enzephalopathie oder Krampfanfälle und Nierenversagen verursachen.
Um das Risiko einer Enzephalopathie zu vermeiden, die bei Dosen über 2 g / kg / Tag DMSO auftritt, werden Infusionen von Stammzellen, die 500 ml überschreiten, über 2 Tage infundiert und die Infusionsgeschwindigkeit ist auf 20 ml / min begrenzt.
Ärzte kontrollieren regelmäßig das Blutbild. Die vollständige Wiederherstellung der Immunfunktion kann bei autologen Transplantatempfängern einige Monate und bei Patienten, die allogene oder syngene Transplantate erhalten, 1 bis 2 Jahre dauern.
Bluttests bestätigen, dass neue Blutzellen produziert werden und dass kein Krebs mehr zurückkommt. Knochenmarkaspiration kann Ärzten auch helfen, festzustellen, wie gut das neue Mark arbeitet
Risiken
Komplikationen im Zusammenhang mit HSCT umfassen sowohl frühe als auch späte Effekte.17
Früh auftretende Probleme umfassen:
- Mucositis
- hämorrhagische Zystitis
- verlängerte, schwere Panzytopenie
- Infektion
- GVHD (Graft versus Host Disease)
- Transplantatversagen
- Lungenkomplikationen
- Lebervenenverschlusskrankheit
- thrombotische Mikroangiopathie
Spät auftretende Probleme beinhalten:
- chronische GVHD
- okulare Effekte
- endokrine Wirkungen
- Lungen-Effekte
- muskuloskelettale Effekte
- neurologische Effekte
- Immuneffekte
- Infektion
- kongestive Herzinsuffizienz
- nachfolgende Malignität
Zu den Hauptrisiken gehören eine erhöhte Anfälligkeit für Infektionen, Anämie, Transplantatversagen, Atemnot und überschüssige Flüssigkeit, was zu Lungenentzündung und Leberfunktionsstörungen führen kann.
Eine Fehlpaarung zwischen Spender- und Empfängergewebe kann zu einer Immunreaktion zwischen Zellen des Wirts und Zellen des Transplantats führen.
Wenn Transplantatzellen Wirtszellen angreifen, ist das Ergebnis eine gefährliche Erkrankung, die Graft-versus-Host-Krankheit (GVHD) genannt wird, die akut oder chronisch sein kann und sich als Hautausschlag, Magen-Darm-Erkrankung oder Lebererkrankung manifestieren kann. Das Risiko einer GVHD kann durch sorgfältige Gewebeanpassung minimiert werden.
Selbst wenn eine Donor-Antigen-Übereinstimmung identisch ist, entwickeln etwa 40 Prozent der Empfänger immer noch eine GVHD, die auf 60 bis 80 Prozent ansteigt, wenn nur ein einzelnes Antigen nicht übereinstimmt. Wegen der Gefahr dieser Komplikation werden autologe Transplantationen häufiger durchgeführt.
Eine Knochenmarkstransplantation wurde bisher nicht für Patienten über 50 Jahren empfohlen, aufgrund einer höheren Mortalität und Morbiditätsrate und einer erhöhten Inzidenz von GVHD bei Patienten über dem Alter von 30 Jahren. Viele Transplantationszentren haben jedoch erfolgreiche Knochenmarktransplantationen bei Patienten weit über dem Alter von 50 Jahren durchgeführt.
Es gibt wenig Risiko für diejenigen, die spenden, weil sie neues Knochenmark erzeugen, um das zu ersetzen, was entfernt wurde. Es besteht jedoch ein geringes Infektionsrisiko und eine Reaktion auf die Anästhesie kann bei jedem chirurgischen Eingriff auftreten.
Krankheiten
Da das Knochenmark viele Körpersysteme beeinflusst, kann ein Problem zu einer Vielzahl von Krankheiten führen, einschließlich Krebs, der das Blut beeinflusst.
Eine Reihe von Krankheiten stellen eine Gefahr für das Knochenmark dar, da sie verhindern, dass Knochenmark Stammzellen in essentielle Zellen verwandelt.
Es ist bekannt, dass Leukämie, Hodgkin-Krankheit und andere Lymphom-Karzinome die produktive Fähigkeit des Marks schädigen und Stammzellen zerstören.
Eine Knochenmarkuntersuchung kann helfen, zu diagnostizieren: 1
- Leukämie
- multiples Myelom
- Gaucher-Krankheit
- ungewöhnliche Fälle von Anämie
- andere hämatologische Erkrankungen.
Eine wachsende Anzahl von Krankheiten kann mit hämatopoetischen Stammzellentransfer (HSCT) behandelt werden.
Mehr als die Hälfte der autologen Transplantationen werden zur Behandlung von multiplem Myelom und Non-Hodgkin-Lymphom durchgeführt. Die meisten allogenen Transplantate werden für hämatologische und lymphoide Karzinome durchgeführt.
Alle 4 Minuten in den Vereinigten Staaten erhält jemand eine Diagnose von Blutkrebs. Eine Knochenmarktransplantation ist oft die beste Überlebenschance.
Etwa 30 Prozent der Patienten finden in ihren Familien einen passenden Spender, aber 70 Prozent oder etwa 14.000 pro Jahr sind auf Knochenmark angewiesen, das von jemandem ohne Bezug zur Verfügung gestellt wurde.
Autologe HSCT wird derzeit verwendet, um zu behandeln:
- multiples Myelom
- Non-Hodgkin-Lymphom
- Hodgkin-Lymphom
- akute myeloische Leukämie
- Neuroblastom
- Keimzelltumoren
- Autoimmunkrankheiten wie systemischer Lupus erythematodes und systemische Sklerose
- Amyloidose
Allogene HSCT wird verwendet, um zu behandeln:
- akute myeloische Leukämie
- akute lymphatische Leukämie
- chronisch-myeloischer Leukämie
- chronischer lymphatischer Leukämie
- myeloproliferative Erkrankungen
- myelodysplastische Syndrome
- multiples Myelom
- Non-Hodgkin-Lymphom
- Hodgkin-Lymphom
- Aplastische Anämie
- pure rote Zellaplasie
- paroxysmale nächtliche Hämoglobinurie
- Fanconi Anämie
- Thalassämie major
- Sichelzellenanämie
- schwerer kombinierter Immundefekt (SCID)
- Wiskott-Aldrich-Syndrom
- Hämophagozytische Lymphohistiozytose
- genetische Stoffwechselstörungen wie Mucopolysaccharidose
- Gaucher-Krankheit, metachromatische Leukodystrophien und Adrenoleukodystrophien
- Epidermolysis bullosa
- schwere kongenitale Neutropenie
- Shwachman-Diamond-Syndrom
- Diamond-Blackfan-Anämie
- Leukozytenadhäsionsdefizienz
HSCT kann auch helfen zu behandeln: 17
- Brustkrebs, obwohl dies nicht bestätigt wird
- Hodenkrebs, bei einigen Patienten im Frühstadium
- einige genetische immunologische oder hämatopoetische Störungen
Knochenmarktransplantationen werden manchmal nach bestimmten Behandlungen wie Hochdosis-Chemotherapie und Strahlentherapie benötigt, um Krebs zu behandeln. Diese Behandlungen schädigen gesunde Stammzellen und zerstören Krebszellen.
Knochenmark-Tests
Knochenmark-Tests können helfen, bestimmte Krankheiten zu diagnostizieren, insbesondere solche, die mit Blut und blutbildenden Organen zusammenhängen. Tests liefern Informationen über Eisenspeicher und Blutproduktion.1
Die Knochenmarkaspiration verwendet eine Hohlnadel, um eine kleine Probe (etwa 1 ml) Knochenmark zur Untersuchung unter einem Mikroskop zu entfernen.
Die Nadel wird bei Erwachsenen gewöhnlich in die Hüfte oder das Sternum eingeführt und bei Kindern in den oberen Teil der Tibia (der größere Knochen des Unterschenkels) eingeführt und Saugen wird verwendet, um die Probe zu extrahieren.
Die Knochenmarkaspiration wird typischerweise durchgeführt, wenn dies durch vorherige Bluttests angezeigt wurde, und ist besonders nützlich bei der Bereitstellung von Informationen über verschiedene Stadien unreifer Blutzellen.
Spende
Es gibt zwei Hauptarten der Knochenmarkspende.
Die erste beinhaltet die Entfernung von Knochenmark von der Rückseite des Beckenknochens.
Die zweite, häufigere Methode heißt periphere Blutstammzellenspende (PBSC). Dazu werden Stammzellen direkt aus dem Blut herausgefiltert. Es sind diese Blutstammzellen und nicht das Knochenmark selbst, die für die Behandlung von Blutkrebs und anderen Krankheiten notwendig sind.
Wenn ein Individuum Mitglied einer Knochenmarkspendenregistrierung wird, stimmen sie zu, mit der Methode zu spenden, die der Arzt des Patienten für angemessen hält.
In Bezug auf die Kosten werden die Kosten für die Blutspende normalerweise von der NMDP oder der Krankenversicherung des Patienten gedeckt. Spender zahlen nie für Spenden, und sie werden nie dafür bezahlt, zu spenden.
Das Risiko für einen Spender ist minimal. Über 99 Prozent der Spender machen nach dem Eingriff eine vollständige Genesung. Bei der Blutspende besteht das Hauptrisiko in der Anwendung der Anästhesie während des Eingriffs.
Bei der PBSC-Spende wird das Verfahren selbst, bei dem Blut durch eine Maschine gefiltert wird, nicht als gefährlich angesehen.
Die Chance, einen geeigneten Knochenmarkspender zu finden, liegt je nach ethnischer Zugehörigkeit zwischen 66 und 93 Prozent.
Wer kann Knochenmark spenden?
Im Folgenden sind einige allgemeine Richtlinien für die Knochenmarkspende aufgeführt, die vom National Marrow Donor Program (NMDP) empfohlen werden.
Die Richtlinien zielen darauf ab, die Gesundheit und Sicherheit des Spenders und des Empfängers zu schützen. Spender werden gebeten, sich an ihr örtliches NMDP-Zentrum zu wenden, um Einzelheiten zu erfahren und Spenden mit ihrem Gesundheitsteam zu besprechen.
- Um in die Registrierung aufgenommen zu werden, müssen potenzielle Spender gesund sein und zwischen 18 und 60 Jahren alt sein.
- Wenn er mit einer Person zusammentrifft, die eine Transplantation benötigt, muss jeder Spender eine medizinische Untersuchung bestehen und vor der Ansteckung infektionsfrei sein.
- Menschen, die Medikamente einnehmen, können normalerweise Knochenmark spenden, solange sie gesund sind und ihre medizinischen Zustände zum Zeitpunkt der Spende unter Kontrolle sind.
Akzeptable Medikamente sind Antibabypillen, Schilddrüsenmedikation. Antihistaminika, Antibiotika, verschreibungspflichtige Augentropfen und topische Medikamente wie Hautcremes. Antiangst und Antidepressiva sind erlaubt, solange der Zustand unter Kontrolle ist.
Spenden ist nicht möglich:
- während der Schwangerschaft
- von jemandem, der intravenöse Medikamente verwendet, die nicht von einem Arzt verschrieben werden
- wenn die Person einen positiven Bluttest auf Hepatitis B oder Hepatitis C hatte
- von denen mit bestimmten medizinischen Bedingungen, wie die meisten Arten von Krebs oder bestimmte Herzerkrankungen
Menschen mit Lyme-Borreliose, Malaria oder kürzlichen Tätowierungen oder Piercings sollten mindestens ein Jahr warten, bevor sie Knochenmark spenden.
Wie wird ein Knochenmark-Match bestimmt?
Nach der Registrierung zur Spende führt die Person einen HLA-Typisierungstest durch, mit dem Patienten mit potenziellen Spendern verglichen werden.
Ihr HLA-Typ wird dann zu einer Datenbank potentieller Spender hinzugefügt, und ein Arzt wird die Registrierung durchsuchen, um zu versuchen, eine Übereinstimmung für ihren Patienten zu finden.
Die Proteine in den Blutzellen werden verglichen, um zu sehen, ob sie denen des Empfängers ähnlich sind. Der potentielle Spender wird kontaktiert, wenn es eine Übereinstimmung gibt.
Je ähnlicher der Gewebetyp des Spenders dem Patienten ist, desto größer ist die Wahrscheinlichkeit, dass der Körper des Patienten das Transplantat annimmt.
Knochenmarkspender weltweit (BMDW) ist eine kollektive Datenbank von 59 Registern in 43 Ländern und 37 Nabelschnurblut-Register aus 21 Ländern; 26,35 Millionen potentielle Stammzellspender und 687 Tausend Nabelschnurbluteinheiten waren per September 2015 verfügbar.19,20 Vorläufige Recherchen durch das NMDP untersuchen routinemäßig auch die BMDW.
Was passiert beim Spenden von Knochenmark?
Folgende Studien werden routinemäßig an hämatopoetischen Stammzellspendern durchgeführt:

- Geschichte und körperliche Untersuchung
- Serum-Kreatinin, Elektrolyt und Leberfunktionsstudien
- serologische Studien für Cytomegalovirus (CMV), Herpesviren, HIV-RNA, Anti-HIV-Antikörper, Hepatitis B- und C-Viren, humanes T-Zell-lymphotropes Virus-1/2 (HTLV-I / II) und Syphilis (VDRL); Bei Eigenblutspenden sind CMV- und VDRL-Tests nicht erforderlich
- ABO Blutgruppe
- HLA-Eingabe
- Thorax-Radiographie
- Elektrokardiographie (EKG)
Spende von peripheren Blutstammzellen (PBSC)
Bevor eine Person PBSC spenden kann, müssen sie in den fünf Tagen vor dem Eingriff tägliche Injektionen eines Medikaments namens Filgrastim erhalten. Dieses Medikament zieht Stammzellen aus dem Knochenmark, so dass der Spender mehr von ihnen im Blut zirkulieren wird.
Das Spenden von PBSC beinhaltet ein Verfahren, das als Apherese bekannt ist. Dies ist, wenn Blut aus dem Körper mit einem Katheter in einem Arm und durch eine Maschine, die Herausfiltern der Stammzellen, zusammen mit Thrombozyten und weißen Blutkörperchen entnommen wird. Das restliche Blut (hauptsächlich bestehend aus Plasma und roten Blutkörperchen) fließt dann durch eine Vene in den anderen Arm zurück in den Körper.
Das Verfahren ist völlig schmerzfrei und ähnelt der Abgabe von Plasma. Die PBSC-Spende erfordert in der Regel zwischen zwei und vier Sitzungen, die jeweils 2 bis 6 Stunden dauern.
Die PBSC-Spende erfordert keine Anästhesie. Die Medikamente, die gegeben werden, um die Mobilisierung (Freisetzung) von Stammzellen aus dem Knochenmark in den Blutkreislauf zu stimulieren, können Knochen- und Muskelschmerzen, Kopfschmerzen, Müdigkeit, Übelkeit, Erbrechen oder Schlafstörungen verursachen. Diese Nebenwirkungen enden normalerweise innerhalb von 2 bis 3 Tagen nach der letzten Dosis des Medikaments.
Knochenmark spenden
Wenn eine Person anstelle von PBSC tatsächlich Knochenmark spendet, besteht keine Notwendigkeit für die Filgrastim-Injektionen. Die Knochenmarkspende ist ein chirurgischer Eingriff, der im Operationssaal durchgeführt wird und eine Narkose erfordert und daher völlig schmerzfrei ist. Der gesamte Vorgang dauert zwischen 1 und 2 Stunden.
In 96 Prozent der Fälle wird eine Vollnarkose eingesetzt, was bedeutet, dass der Spender während des gesamten Eingriffs bewusstlos ist. In einer kleinen Anzahl von Fällen wird ein Lokalanästhetikum verwendet, das den Bereich, aus dem das Knochenmark entnommen wird, betäubt. In dieser Situation ist die Person während des gesamten Verfahrens wach.
Die Person liegt auf dem Bauch. Die Ärzte machen auf beiden Seiten des Beckenknochens einen ungefähr einen viertel Zoll langen Einschnitt. Sie stecken dann spezielle Hohlnadeln in den Knochen, durch die sie das flüssige Mark ziehen. Die Schnitte erfordern normalerweise keine Stiche.
Nach dem Eingriff bleibt der Spender in einem Aufwachraum, bis er das Bewusstsein wiedererlangt. Sobald sie essen, trinken und gehen können, werden sie in der Lage sein zu gehen.
Wiederherstellung
Nach der Spende kann die vollständige Genesung einige Tage dauern, besonders wenn eine Operation notwendig ist.
Menschen, die Knochenmark spenden, haben häufig Kopfschmerzen, Müdigkeit, Muskelschmerzen, Rücken- oder Hüftschmerzen, Blutergüsse an der Einschnittstelle und Schwierigkeiten beim Gehen. Dies kann für bis zu 2 Tage oder mehrere Wochen andauern.
Eine Person, die PBSC spendet, wird wahrscheinlich keine Nebenwirkungen nach der Spende erfahren, außer Quetschungen an der Nadelstelle. Die Erholungszeit ist fast unmittelbar.
Nach der Spende ersetzt sich das Knochenmark innerhalb von 4 bis 6 Wochen.
Ergebnis
Das Ergebnis der Knochenmarktransplantation hängt ab von:
- die Art der Transplantation
- wie eng die Zellen zusammenpassen
- Welche Art von Zustand hat der Patient?
- das Alter und die allgemeine Gesundheit des Patienten
- Art und Dosierung der Chemotherapie oder Strahlentherapie vor der Transplantation
- irgendwelche Komplikationen
Ein Patient, dessen Zustand stabil oder in Remission ist, hat eine bessere Chance auf ein gutes Ergebnis im Vergleich zu jemandem, der eine Transplantation in einem späteren Stadium oder mit einem Rückfall der Krankheit hat. Junges Alter zum Zeitpunkt der Transplantation verbessert auch die Chancen.
Transplantationen für nichtmaligne Erkrankungen neigen zu günstigeren Ergebnissen, mit einer Überlebensrate von 70 bis 90 Prozent, wenn der Spender ein passendes Geschwister ist, und 36 bis 65 Prozent, wenn der Spender nicht verwandt ist.
Transplantate für akute Leukämie in Remission zum Zeitpunkt der Transplantation haben Überlebensraten von 55 bis 68 Prozent, wenn der Spender verwandt ist, und 26 bis 50 Prozent, wenn der Spender nicht verwandt ist.
Eine Knochenmarktransplantation kann Krankheiten ganz oder teilweise heilen. Wenn die Transplantation erfolgreich ist, können die Individuen zu den normalsten Aktivitäten zurückkehren, sobald sie sich gut genug fühlen. Die vollständige Wiederherstellung dauert normalerweise bis zu einem Jahr.