Das Bakterium, das die Hauptursache für eine nekrotisierende Fasziitis oder eine fleischfressende Krankheit ist, verursacht eine weit verbreitete tödliche Infektion, indem es das Nervensystem dazu bringt, das Immunsystem daran zu hindern, es anzugreifen.
Ein Team, das von Wissenschaftlern der Harvard Medical School in Boston, Massachusetts, geleitet wurde, machte die überraschende Entdeckung, als er die krankheitsfördernde Taktik von Mäusen mit nekrotisierender Fasziitis studierte.
Sie können über die Studie in einer Zeitung lesen, die in der Zeitschrift veröffentlicht wird, wo die Forscher auch zwei mögliche Behandlungen vorschlagen.
Sollten sie in Tier- und Menschenversuchen erfolgreich sein, könnten die Behandlungen von immenser Bedeutung sein, um "hoch invasive bakterielle Infektionen" einzudämmen.
"Nekrotisierende Fasziitis", erklärt Senior-Autor Isaac M. Chiu, der Assistenzprofessor für Mikrobiologie und Immunbiologie an der Harvard Medical School ist, "ein verheerender Zustand, der extrem schwierig zu behandeln ist und eine Sterblichkeitsrate aufweist, die unannehmbar hoch ist."
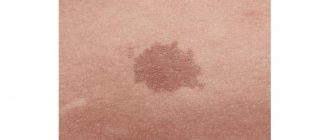
Fleisch fressende Krankheit
Die fleischfressende Krankheit wird durch eine schwere bakterielle Infektion des Unterhautgewebes verursacht, das Gewebe, das direkt unter der Haut liegt, und die Faszie, das Gewebe, das die Organe bedeckt, die im Körper liegen.
Die Krankheit ist sehr selten; Jedes Jahr sind weltweit etwa 200.000 Menschen betroffen, davon rund 1.200 in den USA.
Die Infektion – die durch verschiedene Arten von Bakterien verursacht werden kann – ist nicht einfach zu diagnostizieren und kann sich plötzlich entwickeln und sich schnell ausbreiten. Wenn es nicht sofort behandelt wird, kann es zu "multiplem Organversagen und Tod" kommen, was in etwa 30 Prozent der Fälle auftritt.
Nach einer Verletzung sendet das Nervensystem ein Signal an das Gehirn und ein anderes an das Immunsystem. Das erste Signal löst Schmerzempfindungen aus und das zweite signalisiert dem Immunsystem, sich zurückzuhalten.
Wissenschaftler schlagen vor, dass Neuronen oder Nervenzellen diese Fähigkeit haben, das Immunsystem anzuweisen, sich zurückzuhalten, um eine "Über-Entfaltung" von Immunzellen zu verhindern, die "kollaterale" Schäden an gesundem Gewebe verursachen könnten.
Prof. Chiu interessierte sich dafür, wie dieses Zusammenspiel des Nervensystems und des Immunsystems bei fleischfressenden Krankheiten funktionieren könnte, als er feststellte, dass betroffene Patienten oft übermäßige Schmerzen hatten, die auftraten, bevor sich Symptome entwickelten.
Könnte es sein, dass das Bakterium diese natürliche duale Antwort auf eine Verletzung ausnutzte, um das Immunsystem für seinen eigenen Vorteil zu unterdrücken?
Bakterientoxin löst das Stummschalten des Immunsystems aus
Um dies weiter zu untersuchen, entwickelten er und seine Kollegen ein Mausmodell für fleischfressende Krankheiten, indem sie den Tieren das Bakterium aus infizierten menschlichen Patienten injizierten.
Mit Hilfe des Mausmodells entdeckten sie, dass ein vom Bakterium produziertes Toxin – bekannt als Streptolysin S – ein Auslöser für Schmerzen und das anschließende Ausschalten des Immunsystems war.
In weiteren Tests injizierten sie Mäusen Bakterien, die gentechnisch verändert worden waren, so dass sie das Toxin nicht produzieren konnten. Obwohl sie infiziert wurden, zeigten die Mäuse nicht die üblichen Schmerzen und die Infektion wurde auch nicht invasiv.
Die Forscher bestätigten die Rolle von Streptolysin S durch "Re-Engineering" der Toxin-produzierenden Fähigkeit zurück in die modifizierten Bakterien und dann in die gleichen Mäuse einzuführen. Die Infektion entwickelte sich zu einer ausgewachsenen fleischfressenden Krankheit.
Das Team gab den Mäusen dann einen Antikörper, der das Toxin blockierte. Die Schmerzsymptome der Mäuse waren stark reduziert, was bestätigte, dass bakterielles Streptolysin S der Auslöser war.
Zugrunde liegenden molekularen Mechanismen
Die Forscher führten weitere Experimente durch, in denen sie die zugrunde liegenden molekularen Mechanismen der Interaktion zwischen dem Nervensystem und dem Immunsystem erforschten.
In diesen fanden sie heraus, dass Streptolysin S Neuronen dazu veranlasst, ein Schmerzsignal an das Gehirn zu senden. Dies löst auch ein anderes Signal an das Immunsystem aus, das bewirkt, dass es einen Neurotransmitter oder chemischen Botenstoff, genannt Calcitonin-Gen-verwandtes Peptid (CGRP), sekretiert, der dann die Immunantwort zurückhält.
Sie fanden auch, dass CGRP dies tut, indem es sowohl den Versand von Neutrophilen unterbricht als auch ihre Fähigkeit, Bakterien an der Wundstelle abzutöten, blockiert.
"Effektiv", bemerkt Prof. Chiu, "bringt dieses neuronale Signal das Alarmsystem zum Schweigen, das normalerweise die Infektionskämpfer des Körpers auffordert, die Infektion einzudämmen."
Er fährt fort zu erklären, dass eine solche Reaktion angebracht ist, wenn eine Wunde sauber und nicht infiziert ist – Sie wollen nicht, dass das Immunsystem eindringt und gesundes Gewebe entzündet, um mit einer Infektion fertig zu werden, die nicht da ist.
Aber das Streptokokken-Bakterium nutzt dies aus und ruft die gleiche Strategie auf, wenn die Wunde infiziert ist, wodurch sich die Krankheit ungehindert entwickeln kann.
Patienten im Frühstadium einer nekrotisierenden Fasziitis verspüren oft eine enorme Menge an Schmerzen, zeigen aber nicht die Symptome, die man erwarten könnte – wie Rötung, Schwellung und Entzündung.
Prof. Chiu und seine Kollegen schlagen jedoch vor, dass dies zu erwarten ist, wenn aus irgendeinem Grund die Neutrophilen, die die Entzündung hervorrufen und die Bakterien loswerden, nicht gerufen wurden.
Zwei mögliche Wege, die Krankheit zu stoppen
Die Wissenschaftler führten dann eine weitere Reihe von Experimenten durch, bei denen sie die Bakterien in zwei Gruppen von Mäusen einführten: eine, in der sie die Fähigkeit der Nervenfasern, Schmerzsignale zu tragen, und eine andere, in der sie nicht gestoppt hatten.
Diese zeigten, dass das Blockieren der Schmerznerven die Kontrolle des Körpers über die Infektion verbessert.
Verschiedene Experimente, bei denen Mäusen Botulinum-Neurotoxin A – ein Nervenblocker, der in kosmetischen Gesichtsbehandlungen gegen Falten vorhanden ist – injiziert wurden, zeigten, dass ein solcher Ansatz als eine Behandlung für fleischfressende Erkrankungen funktionieren könnte.
Injektionen des Nervenblockers sogar 2 Tage nachdem die Mäuse zuerst infiziert wurden und bereits Wunden hatten, stoppte die Krankheit, die mehr Gewebeschädigung verursachte.
Die Forscher testeten auch einen anderen möglichen Weg zur Bekämpfung der Krankheit. Sie zeigten, dass CGRP-Blocker das Immunsystem bremsten, indem sie die Nervenzellen daran hinderten, die Haltesignale zu senden. Sie hörten auch auf, dass sich nekrotisierende Fasciitis bei Mäusen ausbreitete.
"Unsere Ergebnisse zeigen eine überraschende neue Rolle von Neuronen in der Entwicklung dieser Krankheit und weisen auf vielversprechende Gegenmaßnahmen hin, die weitere Exploration rechtfertigen."
Prof. Isaac M. Chiu